KRAS G12C抑制剂 全国首个二期关键性临床试验——j9九游会官方网站生物D-1553临床试验火热进行中
1、中国首个获批的KRAS G12C抑制剂在肺癌中的二期关键性临床试验
D1553-102研究是首个国家药监局药品审评中心批准的肺癌二期关键性临床试验。这项关键性注册临床试验于2022年6月获批,用于治疗KRAS G12C突变的晚期或转移性非小细胞肺癌(NSCLC)患者,试验完成后即可递交新药上市申请。
2、D-1553是国内首个被纳入突破性治疗的KRAS G12C抑制剂
D-1553已经于2022年6月10日被国家药监局药品审评中心纳入突破性治疗药物。这是针对KRAS G12C突变的国产创新药首个突破性治疗药物,说明D-1553与现有治疗手段相比有明显的临床优势。
3、D-1553临床疗效显著
D-1553是国内目前公布的临床数据最多,随访时间最长的研究药物。2022年世界肺癌大会(WCLC)公布的D-1553一期临床研究数据显示,在74例可评估的非小细胞肺癌患者中,确认的客观缓解率(ORR)为37.8%,疾病控制率(DCR)高达91.9%。中位无进展生存时间(PFS)为7.6个月。
4、关于D1553-102研究
研究计划:
这是一项针对晚期、不可切除和/或转移性KRAS G12C突变的NSCLC的临床试验,计划在国内约50家医院开展,2期总共计划招募约120例KRAS G12C突变的NSCLC患者,目前该研究正在进行中。
研究条件:
研究药物D-1553是一种用于治疗KRAS G12C突变的试验性药物。本研究已经获得国家药品监督管理局及医院独立伦理委员会/机构审查委员会的审查及批准。
入组要求:
1)年龄≥18岁;
2)具有组织学或细胞学证实的局部晚期、不可切除和/或转移性非小细胞肺癌的受试者;
3)须提供足够且合格的组织样本供中心实验室确认KRAS G12C突变状态;
4)根据RECIST V1.1具有可测量病灶的受试者;
5)有足够的血液学功能、肾功能、肝功能及凝血功能;
6)有能力遵守研究和随访程序。
注:以上为部分主要标准,最终入组标准由研究医生掌握,并以全面体检结果为准。
联系方式:
如果您想获得更多信息,请联系:
研究人员:张老师
联系方式:
咨询时间:周一至周五9:00-17:00
您也可以直接联系以下医院的助理。
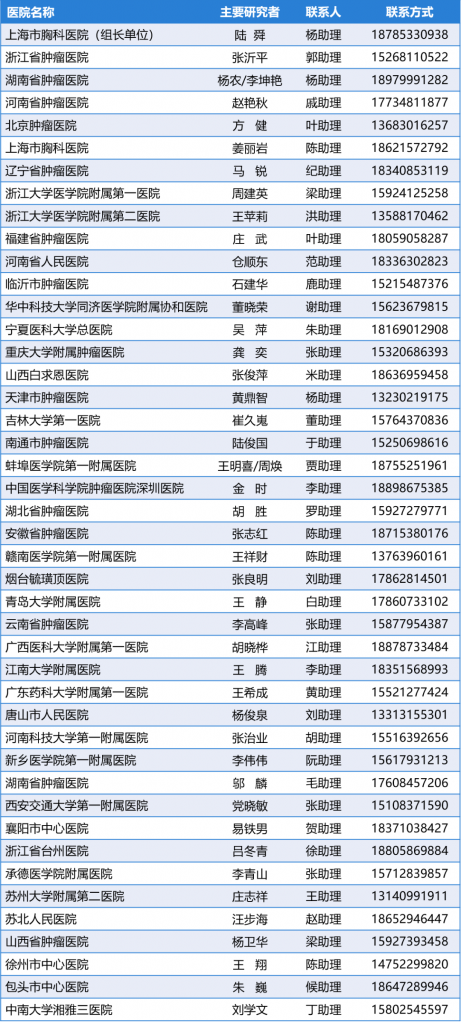
研究中心列表(更新至2022年10月24日):